
产品货号:
WH0118
中文名称:
快速定点突变试剂盒
英文名称:
Fast Site-Directed Mutagenesis Kit
产品规格:
20T
发货周期:
1~3天
产品价格:
询价
本试剂盒提供的FastAlteration DNA Polymerase是一种快速高保真DNA聚合酶,该酶保真性能优良,灵敏度高,扩增速度可达15~30sec/kb,并且最高可扩增长度为10kb的质粒DNA。试剂盒附带的FDM感受态细胞具有体内降解甲基化质粒的功能,可以对未被Dpn I降解掉的质粒模板进行进一步的降解,因此可以保证试剂盒具有更高的阳性率。同时,本试剂盒还为客户提供了对照质粒和引物,方便客户查找实验问题。

体外定点突变技术是当前生物、医学各领域研究中的一种重要实验手段,多用于改造、优化目的基因;探索启动子的调节位点;以及研究蛋白质结构和功能之间的复杂关系。本试剂盒采用目前领先技术,可在目标载体上直接对靶基因进行单点突变,多点突变及插入或缺失突变,并且单点突变的突变率可达90%以上。另外,与以往的突变试剂盒需要多轮PCR及亚克隆等耗时耗力的步骤不同,本试剂盒的操作更为简便,从未突变菌株到突变菌株的构建只需要4步,如下图所示:
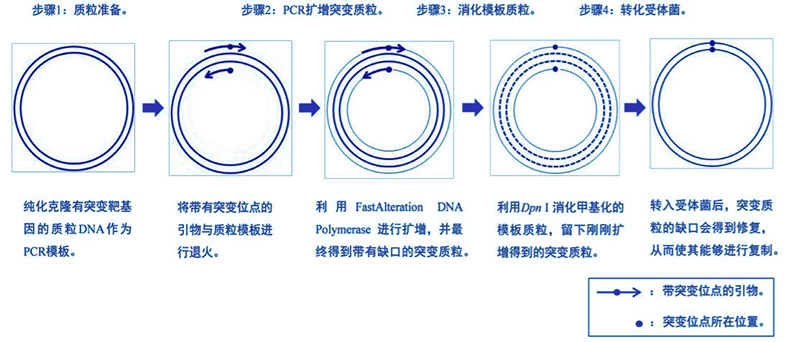

- 简便快速:试剂盒采用非链取代式质粒扩增技术,只需4步即可实现由非突变菌株到突变菌株的转变,而不需要多轮PCR及亚克隆等耗时耗力的步骤。
- 高效引物:试剂盒采用部分重叠的引物设计原则,可以扩增得到更多的突变质粒。
- 应用广泛:本试剂盒不但可进行单点突变,还可以进行多点突变,且突变点数可达5个。
- 适应性强:本试剂盒最大可对10kb的质粒进行定点突变,基本覆盖所有常用质粒。
- 突变率高:本试剂盒具有体外和体内双重消化甲基化质粒模板的功能,可以保证更高的突变率。对于单点突变而言,本试剂盒的突变率可达90%以上。

- 改造优化目的基因和载体;
- 分析启动子上与调控蛋白结合的关键位点;
- 研究蛋白质结构和功能之间的关系。

| 组分 | 规格 |
| FastAlteration DNA Polymerase(1U/μL) | 20μL |
| 5×FastAlteration Buffer | 200μL |
| Dpn I restriction enzyme(20U/μL) | 20μL |
| 4.5kb Control plasmid(5ng/μl) | 40μL |
| Control primers(5μM,each) | 80μL |
| FDM competent cells | 20×50μL |
保存:-20℃,有效期1年,其中感受态细胞须置于-70℃,可保存6个月。

- 在进行单引物多位点突变时,由于增加了突变位点个数,所以突变率较单点突变时会有所降低,根据我们的实验数据,当突变位点个数达到5个时,突变阳性率会降低到50%。因此建议客户要增加验证的克隆子数。
- 本试剂盒支持多引物多位点突变,这样可以在基因内更广泛的范围内进行突变实验。突变位点个数的上限仍然是5个。
- 建议在进行新的突变实验时要带上试剂盒附带的对照质粒和引物,以便于对实验问题进行分析。

- 两条引物上都要包含突变位点,且除突变位点以外的碱基都要与质粒模板互补配对。
- 若引物中只有一个突变位点,则需采用图2-A的设计原则。此类引物包括5'重叠区和3'延伸区两部分。引物总长度大约为30nt,其中5'重叠区为15~20nt,3'延伸区至少为10nt。突变位点在正向突变引物的重叠区以后,反向突变引物的5'末端。
- 若引物上含有2~5个突变位点,则需采用图2-B的设计原则。此类引物的两条序列完全互补,分为突变区和非突变区两部分。引物总长度大约为40nt,其中突变区为15~20nt,非突变区至少10nt。根据实验需求可在突变区内设计2~5个突变位点。
- 为保证高突变率,突变引物需通过FPLC或PAGE方式纯化。
- 突变引物Tm值的计算按下列公式进行:
Tm = 81.5 + 0.41(GC%) - 675/N - mismatch% (N:引物长度)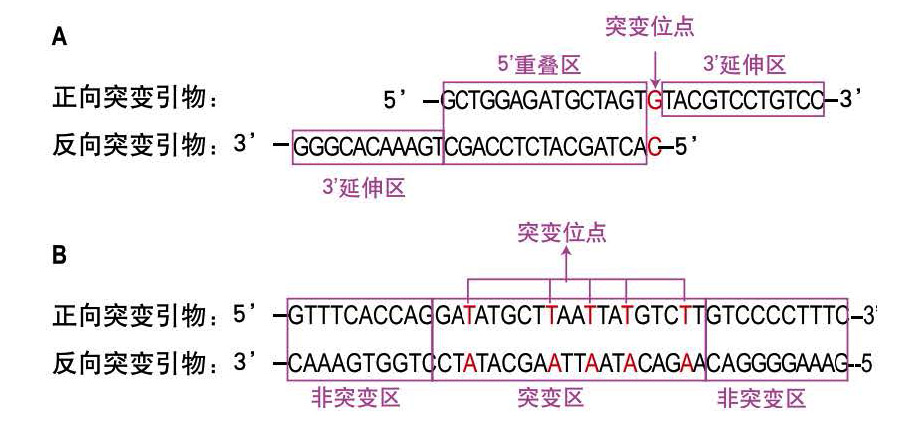
图2.快速定点突变试剂盒引物设计原则

一、建立PCR反应体系
注意:以下举例仅供参考,实际反应条件因模板、引物等的机构不同而各异,需根据实际情况,设定最佳反应条件。
- 将-20℃保存的PCR反应相关试剂,突变引物及模板质粒解冻并混匀。
- 按照下表中各成分的加入量配制反应体系:
成分 用量 终浓度 DNA Template 10~100ng - 正向突变引物(10μM) 2μL 400nM 反向突变引物(10μM) 2μL 400nM 5×FastAlteration Buffer 10μL 1× FastAlteration DNA Polymerase(1U/μL) 1μL 0.02U/μL RNase-Free ddH2O 至50μL - - 按照下表体系配制对照组PCR体系:
成分 用量 终浓度 4.5kb Control plasmid(5ng/μL) 2μL 0.2ng/μL Control primers(5μM,each) 4μL 400nM 5×FastAlteration Buffer 10μL 1× FastAlteration DNA Polymerase(1U/μL) 1μL 0.02U/μL RNase-Free ddH2O 至50μL - - 将实验组及对照组按照如下PCR反应程序进行PCR反应。
PCR反应程序:
注:下表中PCR程序按照对照组实验条件设置,客户可根据自身实验进行相应调整。步骤 温度 时间 循环数 预变性 95℃ 2min 1 变性 94℃ 20sec 18 退火 55℃ 10sec 延伸 68℃ 2.5min 补充延伸 68℃ 5min 1
二、质粒模板的消化
- 按照下表所述配制酶切体系:
成分 用量 终浓度 PCR产物 50μL - Dpn I restriction enzyme(20U/μL) 1μL 0.4U/μL - 充分混匀后,将上述酶切体系于37℃条件下消化1h。
三、转化宿主菌
注:此转化流程为通用流程,可用于实验组及对照组。
- 从-90~-65℃冰箱中取出1支FDM感受态细胞置于冰上解冻。
- 感受态细胞解冻后,加入5μL Dpn I消化产物(在感受态细胞刚刚解冻时加入产物),继续冰浴30min。
- 42℃准确热激90sec,立即置于冰上2min。
- 加入350μL无菌的SOC或LB培养基(不含抗生素),混匀后置于37℃摇床振荡培养45~60min (150转/分钟),使菌体复苏。
- 孵育结束后,将离心管内菌液混匀,并将所有菌液涂布到含相应抗生素的LB固体琼脂培养基上,将平板置于室温直至液体被吸收,倒置平板,37℃培养12~16h。
- 待菌落长出后,进行突变克隆筛选。
四、根据对照组统计突变结果
试剂盒提供的对照质粒和对照引物主要用于评估试剂盒的突变率。在氨苄抗性的平板上,涂布20μL 0.2M的IPTG和40μL 40mg/mL的X-gal,正常情况下,对照组在上述平板上的菌落生长数应该在50个以上,且阳性突变菌株显蓝色,因为对照质粒上的lacZ基因是经过改造的,而成功的突变会使其恢复成野生型。因此可根据菌落的颜色推断本次操作的阳性突变率,具体计算公式如下:
| 突变率= | 呈蓝色的菌落数(cfu) | ×100% |
| 平板上所有的菌落数 |

| 问题 | 可能的原因 | 建议解决方法 |
| 转化效率低或菌落数少 | 反应体系中扩增出的突变质粒量不足 | 增加转化体系的量至10μL。 |
| PCR反应体系中模板质粒量不足 | 将模板质粒进行琼脂糖凝胶电泳及定量分析,以确定质粒的质量和浓度是否符合试剂盒要求。 | |
| 对照组突变率低或者菌落数少 | PCR程序不适宜 | 确定PCR程序适宜对照组要求,并用确定后的程序再进行—次对照组实验以彻底排除PCR程序的影响。 |
| 扩增产物不足 | 可将PCR反应的循环数增加至25个。 | |
| 感受态细胞保存不当 | 收到试剂盒以后应第一时间将感受态细胞转入-90~-65℃冰箱中保存,且应将感受态放于冰箱的里面而不要放在门口。 | |
| X-gal和IPTG的用量不足 | 对本试剂盒而言,应在氨苄抗性的平板上,涂布20μL 0.2M的IPTG和40μL 40mg/mL的X-gal,才能保证阳性突变株的菌落变为蓝色。 | |
| 5×PCR反应Buffer反复冻融 | 此Buffer中含有dNTP等容易降解的成分,反复冻 融会加速这些物质的降解,因此,在实际操作中应尽量避免对5×PCR反应Buffer的反复冻融。 | |
| 实验组突变率低或者菌落数少 | PCR程序不适宜 | 确定PCR程序适宜实验组要求,并用确定后的程序再进行一次对照组实验以彻底排除PCR程序的影响。 |
| 反应体系混合不均匀 | 用移液器轻轻吸打将反应体系混合混匀。 | |
| 加入DpnI后未混匀充分 | 酶切阶段,加入Dpnl后一定要用移液器轻轻吸打多次以保证DpnI与PCR体系混合均匀。 | |
| 转化体系中质粒模板过剩 | 质粒模板过剩会极大的影响突变效率。若排除其他影响后,突变率仍然很低,可以考虑增加DpnI的用量至2μL或延长酶切时间至1.5h。 | |
| 5×PCR反应Buffer反复冻融 | 此Buffer中含有dNTP等容易降解的成分,反复冻融会加速这些物质的降解,因此,在实际操作中应尽量避免对5×PCR反应Buffer的反复冻融。 |
相关搜索:快速定点突变试剂盒,定点突变试剂盒,Fast Site-Directed Mutagenesis Kit



